进口医疗器械,没有国内的注册证,到港了怎么办?
发布日期:2026-02-06 浏览次数:5
对于没有中国医疗器械注册证的设备已经到港的情况,确实会非常棘手。不过,处理方式并非只有“退运”一条路,关键要看您进口的具体目的和用途。
下面为您梳理一下可能面对的情况和可以采取的行动。
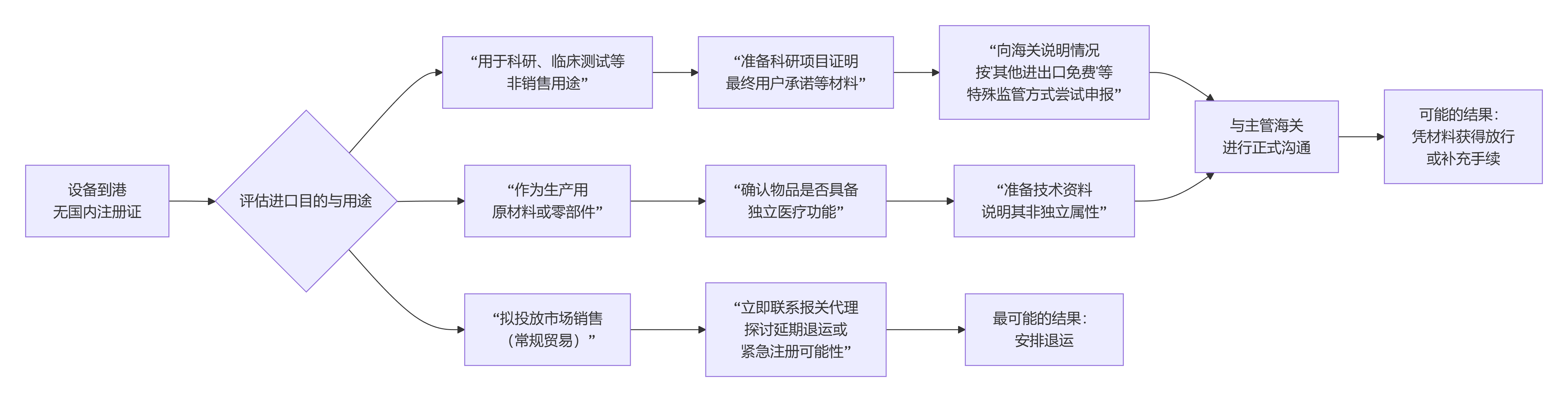
一、 核心原则:没有注册证,通常无法正常通关
首先必须明确,中国的法规要求,除特殊情况外,进口的医疗器械必须是已在我国注册或备案的产品。海关在查验时,会联网核查注册证信息。如果无法提供,货物将无法清关,最直接的后果就是 “退运”。
但是,以下两种特殊情况可以作为您与海关沟通的切入点。
二、 特殊情况:这些用途可能有“绿色通道”
如果您的设备属于以下用途,可以准备相应证明材料,尝试向海关说明情况:
1.用于科研、测试等非贸易用途
这是最常见的一种例外情况。如果您能证明该设备将专门用于科学研究、临床试验或产品注册前的测试,而非直接销售使用,则存在合规进口的可能性。
如何操作:通常可以按“其他进出口免费”(监管代码3399)等方式申报。
需要准备的关键文件:您需要向海关提交科研项目证明、最终用户说明以及承诺书,承诺设备仅用于指定科研用途、不会在市场流通。
2.作为医疗器械的生产原材料或零部件
如果进口的“物品”本身是用于生产医疗器械的原材料、零部件或辅料,且不单独作为医疗器械使用,则可能不需要单独的注册证。但需注意,如果是一个具备独立功能的医疗器械核心模块(如一台设备的高压发生器),则很可能仍需要证。
3.申请地区性的“白名单”试点
目前,部分省市(如湖北、上海等地)为支持生物医药产业研发,试点推出了 “白名单”制度。被认定的研发单位,进口已列入清单的研发用物品(包括国外已上市、国内未注册的医疗器械或零部件)时,可享受通关便利。您可以咨询当地商务或药监部门,了解所在地区是否有此政策。
三、 紧急应对与行动建议
如果设备已抵港,请立即按以下路径评估和行动:
给您的具体建议:
立即与您的报关代理沟通:第一时间告知代理全部实情,包括设备的具体用途(是否用于科研?还是作为配件?),他们会提供最直接的港口操作建议。
主动联系主管海关:在报关行协助下,尽快向货物所在口岸的海关进行说明,提交上述可能适用的证明材料,争取沟通空间。
长期规划,合规先行:如果未来需要经常进口类似设备,务必提前规划。对于拟在中国销售的设备,必须提前完成医疗器械注册或备案;对于研发用途,可探索申请加入所在地的 “白名单”试点。
总而言之,货到港发现没证,首要任务是厘清用途、准备证据、积极沟通。最坏的结果是退运,但如果能证明符合科研等例外规定,仍有挽回的余地。
如果您能提供更多关于设备具体用途的信息,我可以为您提供更具体的分析。